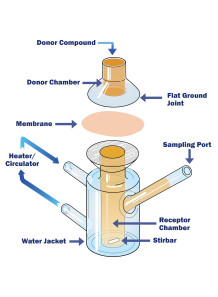
Intestine Absorption (Franz Cell, Porcine Intestine, Krebs-Ringer, 1 Time Point)
- Product Code: 125440
บริการวิเคราะห์การซึมผ่านของลำไส้ด้วย Franz Cell โดยใช้ลำไส้เล็กของสุกรพร้อมบัฟเฟอร์ Krebs-Ringer HEPES
- -
- -
- -
- -
- -
- -
- -
- -
- -
- -
- -
- -
- -
- -
- -
- -
- -
การทดสอบดูดซึมของลำไส้ Intestine Absorption (Franz Cell, Porcine Intestine, Krebs-Ringer, 1 Time Point)
วัสดุที่ต้องการ:
- เซลล์การแพร่กระจายของฟรานซ์
- ลำไส้หมู (สดหรือเก็บไว้อย่างเหมาะสม)
- บัฟเฟอร์ Krebs-Ringer (บัฟเฟอร์ HEPES หรือโซเดียมไบคาร์บอเนต ขึ้นอยู่กับการตั้งค่า)
- ช่องผู้บริจาคและตัวรับสำหรับเซลล์ฟรานซ์
- เครื่องกวนแม่เหล็ก
- เข็มฉีดยาและเข็ม
- เครื่องวัดพีเอช
- ตู้ฟักหรืออ่างน้ำ (หากจำเป็นเพื่อรักษาอุณหภูมิ)
- เครื่องมือวิเคราะห์ (เช่น HPLC, สเปกโตรโฟโตมิเตอร์) สำหรับการวิเคราะห์ตัวอย่าง
- สารประกอบการดูดซึม (สารทดสอบ)
การตระเตรียม:
-
เตรียมบัฟเฟอร์ Krebs-Ringer :
- สำหรับบัฟเฟอร์ HEPES: ละลาย NaCl, KCl, CaCl₂, MgSO₄, NaH₂PO₄, กลูโคส และ HEPES ในปริมาณที่เหมาะสมในน้ำกลั่น ปรับ pH เป็น 7.4
- สำหรับบัฟเฟอร์โซเดียมไบคาร์บอเนต: เตรียมในลักษณะเดียวกันแต่ใช้ NaHCO₃ แทน HEPES และปรับ pH ด้วยสภาพแวดล้อม CO₂ หากจำเป็น
-
เตรียมลำไส้หมู :
- รับลำไส้หมูสดจากแหล่งที่เหมาะสม
- ทำความสะอาดลำไส้เพื่อขจัดเนื้อหาและเศษเยื่อเมือก
- ตัดลำไส้ออกเป็นส่วนที่เหมาะสมสำหรับติดบนเซลล์ฟรานซ์
-
ติดเนื้อเยื่อลำไส้ :
- ติดตั้งส่วนของลำไส้อย่างระมัดระวังระหว่างช่องผู้บริจาคและตัวรับของเซลล์ฟรานซ์ ตรวจสอบให้แน่ใจว่าไม่มีการรั่วไหลและเนื้อเยื่ออยู่ในตำแหน่งที่ปลอดภัย
การตั้งค่าการทดสอบ:
-
เติมช่องรับน้ำ :
- เติมบัฟเฟอร์ Krebs-Ringer ในช่องตัวรับ เพื่อให้แน่ใจว่าส่วนผสมเข้ากันดีและมีอากาศถ่ายเท ช่องนี้จะเลียนแบบฝั่งเลือดของลำไส้
- วางแท่งแม่เหล็กในช่องตัวรับเพื่อการผสมอย่างต่อเนื่อง
-
เพิ่มสารประกอบทดสอบลงในช่องผู้บริจาค :
- ใส่สารประกอบทดสอบ (สารที่คุณต้องการศึกษาเพื่อการดูดซึม) ไปที่ช่องผู้บริจาค ช่องนี้แสดงถึงด้านลูเมนของลำไส้
- สารประกอบควรอยู่ในตัวทำละลายหรือพาหะที่เหมาะสมซึ่งไม่ทำลายเนื้อเยื่อ
-
รักษาเงื่อนไขการทดลอง :
- วางเซลล์ฟรานซ์ไว้ในตู้ฟักหรืออ่างน้ำเพื่อรักษาอุณหภูมิทางสรีรวิทยา (ปกติจะอยู่ที่ประมาณ 37°C)
- ตรวจสอบให้แน่ใจว่ามีการคนอย่างต่อเนื่องในช่องตัวรับเพื่อจำลองการไหลเวียนของเลือดและเพื่อป้องกันการก่อตัวของชั้นขอบเขต
การสุ่มตัวอย่าง:
-
การเก็บตัวอย่าง :
- ตามช่วงเวลาที่กำหนดไว้ล่วงหน้า (เช่น ทุกๆ 30 นาทีหรือทุกชั่วโมง) ให้ถอนของเหลวจำนวนเล็กน้อยออกจากช่องรับยาโดยใช้หลอดฉีดยา
- เปลี่ยนปริมาตรที่ถอนออกด้วยบัฟเฟอร์ Krebs-Ringer ใหม่เพื่อรักษาปริมาตรให้คงที่
-
วิเคราะห์ตัวอย่าง :
- วิเคราะห์ตัวอย่างที่เก็บมาโดยใช้เทคนิคการวิเคราะห์ที่เหมาะสม (เช่น HPLC, UV-spectrophotometry) เพื่อกำหนดความเข้มข้นของสารประกอบทดสอบ
- พล็อตความเข้มข้นของสารประกอบทดสอบในช่องของตัวรับเมื่อเวลาผ่านไปเพื่อประเมินอัตราการดูดซึม
Be the first to review this product :-)
บริการวิเคราะห์
| บริการแลป | ราคา |
|---|
Intestine Absorption (Franz Cell, Porcine Intestine, Krebs-Ringer, 1 Time Point)
บริการวิเคราะห์การซึมผ่านของลำไส้ด้วย Franz Cell โดยใช้ลำไส้เล็กของสุกรพร้อมบัฟเฟอร์ Krebs-Ringer HEPES
การทดสอบดูดซึมของลำไส้ Intestine Absorption (Franz Cell, Porcine Intestine, Krebs-Ringer, 1 Time Point)
วัสดุที่ต้องการ:
- เซลล์การแพร่กระจายของฟรานซ์
- ลำไส้หมู (สดหรือเก็บไว้อย่างเหมาะสม)
- บัฟเฟอร์ Krebs-Ringer (บัฟเฟอร์ HEPES หรือโซเดียมไบคาร์บอเนต ขึ้นอยู่กับการตั้งค่า)
- ช่องผู้บริจาคและตัวรับสำหรับเซลล์ฟรานซ์
- เครื่องกวนแม่เหล็ก
- เข็มฉีดยาและเข็ม
- เครื่องวัดพีเอช
- ตู้ฟักหรืออ่างน้ำ (หากจำเป็นเพื่อรักษาอุณหภูมิ)
- เครื่องมือวิเคราะห์ (เช่น HPLC, สเปกโตรโฟโตมิเตอร์) สำหรับการวิเคราะห์ตัวอย่าง
- สารประกอบการดูดซึม (สารทดสอบ)
การตระเตรียม:
-
เตรียมบัฟเฟอร์ Krebs-Ringer :
- สำหรับบัฟเฟอร์ HEPES: ละลาย NaCl, KCl, CaCl₂, MgSO₄, NaH₂PO₄, กลูโคส และ HEPES ในปริมาณที่เหมาะสมในน้ำกลั่น ปรับ pH เป็น 7.4
- สำหรับบัฟเฟอร์โซเดียมไบคาร์บอเนต: เตรียมในลักษณะเดียวกันแต่ใช้ NaHCO₃ แทน HEPES และปรับ pH ด้วยสภาพแวดล้อม CO₂ หากจำเป็น
-
เตรียมลำไส้หมู :
- รับลำไส้หมูสดจากแหล่งที่เหมาะสม
- ทำความสะอาดลำไส้เพื่อขจัดเนื้อหาและเศษเยื่อเมือก
- ตัดลำไส้ออกเป็นส่วนที่เหมาะสมสำหรับติดบนเซลล์ฟรานซ์
-
ติดเนื้อเยื่อลำไส้ :
- ติดตั้งส่วนของลำไส้อย่างระมัดระวังระหว่างช่องผู้บริจาคและตัวรับของเซลล์ฟรานซ์ ตรวจสอบให้แน่ใจว่าไม่มีการรั่วไหลและเนื้อเยื่ออยู่ในตำแหน่งที่ปลอดภัย
การตั้งค่าการทดสอบ:
-
เติมช่องรับน้ำ :
- เติมบัฟเฟอร์ Krebs-Ringer ในช่องตัวรับ เพื่อให้แน่ใจว่าส่วนผสมเข้ากันดีและมีอากาศถ่ายเท ช่องนี้จะเลียนแบบฝั่งเลือดของลำไส้
- วางแท่งแม่เหล็กในช่องตัวรับเพื่อการผสมอย่างต่อเนื่อง
-
เพิ่มสารประกอบทดสอบลงในช่องผู้บริจาค :
- ใส่สารประกอบทดสอบ (สารที่คุณต้องการศึกษาเพื่อการดูดซึม) ไปที่ช่องผู้บริจาค ช่องนี้แสดงถึงด้านลูเมนของลำไส้
- สารประกอบควรอยู่ในตัวทำละลายหรือพาหะที่เหมาะสมซึ่งไม่ทำลายเนื้อเยื่อ
-
รักษาเงื่อนไขการทดลอง :
- วางเซลล์ฟรานซ์ไว้ในตู้ฟักหรืออ่างน้ำเพื่อรักษาอุณหภูมิทางสรีรวิทยา (ปกติจะอยู่ที่ประมาณ 37°C)
- ตรวจสอบให้แน่ใจว่ามีการคนอย่างต่อเนื่องในช่องตัวรับเพื่อจำลองการไหลเวียนของเลือดและเพื่อป้องกันการก่อตัวของชั้นขอบเขต
การสุ่มตัวอย่าง:
-
การเก็บตัวอย่าง :
- ตามช่วงเวลาที่กำหนดไว้ล่วงหน้า (เช่น ทุกๆ 30 นาทีหรือทุกชั่วโมง) ให้ถอนของเหลวจำนวนเล็กน้อยออกจากช่องรับยาโดยใช้หลอดฉีดยา
- เปลี่ยนปริมาตรที่ถอนออกด้วยบัฟเฟอร์ Krebs-Ringer ใหม่เพื่อรักษาปริมาตรให้คงที่
-
วิเคราะห์ตัวอย่าง :
- วิเคราะห์ตัวอย่างที่เก็บมาโดยใช้เทคนิคการวิเคราะห์ที่เหมาะสม (เช่น HPLC, UV-spectrophotometry) เพื่อกำหนดความเข้มข้นของสารประกอบทดสอบ
- พล็อตความเข้มข้นของสารประกอบทดสอบในช่องของตัวรับเมื่อเวลาผ่านไปเพื่อประเมินอัตราการดูดซึม
| Mechanism | - |
| Appearance | - |
| Longevity | - |
| Strength | - |
| Storage | - |
| Shelf Life | - |
| Allergen(s) | - |
| Dosage (Range) | - |
| Recommended Dosage | - |
| Dosage (Per Day) | - |
| Recommended Dosage (Per Day) | - |
| Mix Method | - |
| Heat Resistance | - |
| Stable in pH range | - |
| Solubility | - |
| Product Types | - |
| INCI | - |
ตะกร้า
ไม่มีสินค้า
Subtotal:
£0.00
£0.00
รวมทั้งสิ้น :