Salmonella Counting Service
- Product Code: 127388
บริการนับจำนวน Salmonella
description ภาพรวมบริการ
ขั้นตอนการทดสอบ Salmonella
1. การเก็บตัวอย่างและการเตรียมตัวอย่าง
-
การเก็บตัวอย่างอย่างถูกวิธี (Aseptic Sampling):
เก็บตัวอย่าง (เช่น อาหาร น้ำ หรือการเก็บจากสิ่งแวดล้อม) โดยใช้เทคนิคที่ปราศจากการปนเปื้อน -
ขนาดตัวอย่าง:
- ตัวอย่างของแข็ง: ชั่งน้ำหนัก 25 กรัม
- ตัวอย่างของเหลว: ใช้ปริมาณที่เหมาะสม (เช่น 25–100 mL)
-
การบดและผสม (Homogenization):
นำตัวอย่างไปใส่ในภาชนะที่ปราศจากเชื้อแล้วเติมด้วย Buffered Peptone Water (BPW) ในอัตราส่วน 1:10 (เช่น 25 กรัมใน 225 mL BPW) จากนั้นบดหรือผสมให้เข้ากันโดยใช้เครื่องบด (stomacher) หรือเครื่องปั่น
2. การเพิ่มจำนวนในช่วงเริ่มต้น (Pre-enrichment)
-
วัตถุประสงค์:
เพื่อฟื้นฟูเซลล์ Salmonella ที่อาจได้รับความเครียดหรือบาดเจ็บและมีจำนวนต่ำในตัวอย่าง -
ขั้นตอน:
บ่มตัวอย่างที่ผสมใน BPW ที่อุณหภูมิ 35 ± 1°C เป็นเวลา 18–24 ชั่วโมง ขั้นตอนนี้ช่วยเพิ่มจำนวนเซลล์ Salmonella ที่มีชีวิตก่อนเข้าสู่ขั้นตอนการเพิ่มจำนวนแบบคัดเลือก
3. การเพิ่มจำนวนแบบคัดเลือก (Selective Enrichment)
-
เหตุผล:
หลังจากการเพิ่มจำนวนในช่วงเริ่มต้น ตัวอย่างจะถูกโอนเข้าสู่น้ำยาเพิ่มจำนวนที่มีลักษณะคัดเลือกเพื่อส่งเสริมการเจริญเติบโตของ Salmonella ในขณะที่ยับยั้งจุลชีพอื่น ๆ -
น้ำยาเพิ่มจำนวนที่นิยมใช้:
- Rappaport-Vassiliadis (RV) Broth: บ่มที่อุณหภูมิ 42 ± 0.5°C เป็นเวลา 24 ชั่วโมง
- Selenite Cystine (SC) Broth: บ่มที่อุณหภูมิ 35 ± 1°C เป็นเวลา 24 ชั่วโมง
(บางโปรโตคอลอาจใช้ทั้งสองน้ำยาในเวลาเดียวกันเพื่อเพิ่มความไวในการตรวจ)
4. การหว่านตัวอย่างลงบนสื่อเพาะเชื้อแบบคัดเลือก (Plating on Selective Agar Media)
-
วัตถุประสงค์:
เพื่อแยกและนับฝักของ Salmonella จากน้ำยาเพิ่มจำนวน -
สื่อเพาะเชื้อแบบคัดเลือก/แยกสีที่นิยมใช้:
- Xylose Lysine Deoxycholate (XLD) Agar: Salmonella มักปรากฏเป็นฝักสีแดงที่มีจุดสีดำตรงกลาง
- Hektoen Enteric (HE) Agar: Salmonella ปรากฏเป็นฝักสีเขียว-น้ำเงิน โดยอาจมีหรือไม่มีจุดสีดำ
- Bismuth Sulfite (BS) Agar หรือ Salmonella-Shigella (SS) Agar: ใช้ในบางกรณี
-
เทคนิคการหว่านตัวอย่าง:
- การหว่านตรง: หยดหรือแพร่ตัวอย่างจากน้ำยาเพิ่มจำนวนลงบนแผ่นเพาะเชื้อ
- การเจือจางอนุกรม (สำหรับการนับจำนวน): หากคาดว่ามีจำนวนแบคทีเรียสูง ให้ทำการเจือจางอนุกรมของตัวอย่างที่เพิ่มจำนวนแล้วและหว่านลงบนแผ่นเพาะเพื่อให้ได้จำนวนนับที่เหมาะสม (โดยทั่วไปอยู่ในช่วง 25–250 ฝักต่อแผ่น)
-
การบ่ม (Incubation):
นำแผ่นเพาะเชื้อไปบ่มที่อุณหภูมิ 35 ± 1°C เป็นเวลา 24–48 ชั่วโมง หรือปฏิบัติตามคำแนะนำของผู้ผลิตสื่อเพาะเชื้อหรือวิธีการมาตรฐานที่ใช้
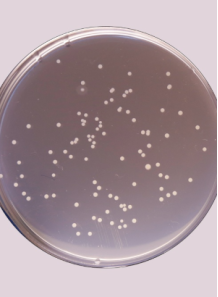
5. การนับฝักและการระบุเบื้องต้น
-
การนับฝัก:
หลังการบ่ม นับจำนวนฝักที่แสดงลักษณะตามที่คาดว่าจะเป็นของ Salmonella บนสื่อเพาะเชื้อแบบคัดเลือก- หมายเหตุ: ควรนับเฉพาะแผ่นเพาะที่มีจำนวนฝักอยู่ในช่วงที่เชื่อถือได้ (โดยทั่วไป 25–250 ฝัก) เพื่อความแม่นยำในการนับ
-
การสังเกตลักษณะทางจุลชีววิทยา:
สังเกตฝักที่มีลักษณะเฉพาะของ Salmonella (เช่น บน XLD agar ฝักสีแดงพร้อมจุดสีดำตรงกลาง)
6. การยืนยันตัวตนของ Salmonella
เนื่องจากแบคทีเรียชนิดอื่นบางชนิดอาจสร้างฝักที่มีลักษณะคล้ายกันกับ Salmonella จึงจำเป็นต้องทำการยืนยันฝักที่น่าสงสัยโดยใช้วิธีดังต่อไปนี้:
-
การทดสอบชีวเคมี (Biochemical Tests):
- Triple Sugar Iron (TSI) Agar: สังเกตสไล้ที่เป็นด่าง (alkaline) พร้อมส่วนท้องที่เป็นกรด (acidic) และการผลิตไฮโดรเจนซัลไฟด์ (H₂S) ซึ่งทำให้เกิดการเปลี่ยนสีเป็นสีดำ
- การทดสอบ Urease: Salmonella มักให้ผลเป็นลบ
- การทดสอบความเคลื่อนไหว (Motility Test): ส่วนใหญ่ Salmonella มีความสามารถในการเคลื่อนไหว
timeline ขั้นตอนการให้บริการ
| ขั้นตอน | ขั้นตอน | ผลลัพธ์ที่คาดหวัง |
|---|---|---|
| info ขั้นตอนการให้บริการจะแจ้งให้ทราบเมื่อมีการร้องขอ | ||
ตะกร้า
ไม่มีสินค้า